近日,华东理工大学李永生教授团队与同济大学附属上海市肺科医院张鹏教授团队合作,基于肿瘤代谢重编程需要大量摄取葡萄糖的特点,提出了一种独特的抑制葡萄糖摄取的阀门关闭策略,特异性地让肿瘤细胞进入对化疗药敏感的饥饿状态,从而增强化疗效果,并显著降低传统化疗过程带来的毒副作用。
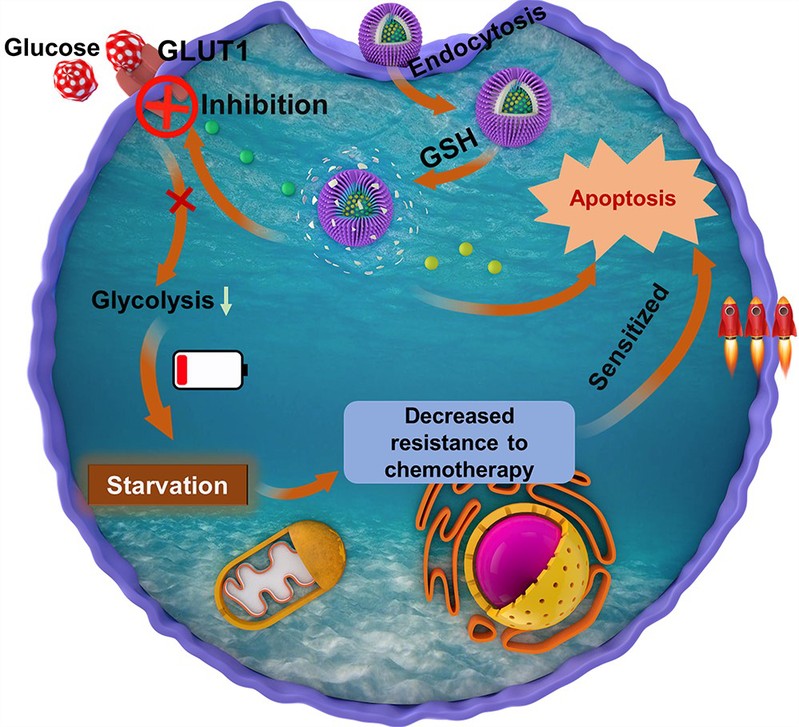
阀门关闭型饥饿策略用于特异性增强肿瘤化疗效果示意图
化疗是目前治疗不可切除肿瘤的最主要方法之一,但如何降低其在临床表现出的较大毒副作用仍然面临巨大挑战。尽管研究者们已经开发了不同的纳米载体来提高化疗药物递送的效率并减少副作用,但肿瘤细胞独特的代谢变化会导致它们对化疗干预产生抵抗,从而影响治疗效果。因此,如何提升化疗效果的同时降低副作用仍是亟需解决的关键问题。最近的研究表明,短期禁食或模拟禁食饮食可以使癌细胞对化疗更加敏感,同时保护正常细胞免受化疗药物的毒性作用,这种差异性行为被称为差异应激效应。具体来说,在饥饿状态下,正常细胞倾向于将自身从正常的增殖状态转变为维持状态,以节省足够的能量来维持其细胞器的功能,从而保护自己免受化疗药物的毒性。然而,由于致癌突变的存在,无论能量短缺与否,肿瘤细胞始终处于高代谢和增殖状态。能量供应不足会造成癌细胞的细胞器功能障碍,导致它们对化疗药毒性的抵抗能力降低,从而更容易受到化疗药物的影响。但是,这种长达几天的禁食往往使患者很难忍受,并有可能导致其他的代谢综合征。相对来讲,特异性地让肿瘤饥饿则是一个有效的解决途径。当前的肿瘤饥饿方式主要分为基于葡萄糖氧化酶(GOx)的葡萄糖耗尽和血管栓塞,但前者往往受限于GOx的稳定性差、全身毒性、加剧肿瘤缺氧等问题,后者则受限于快速的血流冲洗而使血管闭塞无效或导致未预料到的血栓形成。因此,探索新的肿瘤特异性饥饿策略迫在眉睫。
作为重要的跨膜蛋白家族,葡萄糖转运蛋白(GLUTs)可帮助细胞外亲水的葡萄糖进入细胞,因此可将其视作控制细胞持续摄取葡萄糖的阀门。基于肿瘤代谢重编程需要大量摄取葡萄糖的特点,研究人员设计了一种含有GLUT1抑制剂(染料木素)和化疗药(姜黄素)的含双硫键的有机硅杂化胶束材料,当其通过EPR效应进入高GSH浓度的肿瘤部位特异性释放货物后,GLUT1的表达被高效抑制致使肿瘤细胞无法摄取葡萄糖(阀门关闭)而进入对化疗药敏感的饥饿状态,从而增强化疗药的治疗效果。在相关体内实验中,这种有机硅杂化胶束材料表现出明显的抑制HeLa肿瘤生长的性能,并且在正常组织低GSH浓度和差异应激效应的共同作用下,未表现出明显的对正常组织的毒副作用。因此,这种用于特异性增强肿瘤化疗的“阀门关闭”饥饿策略为高效低毒的肿瘤治疗提供了新的思路。
相关论文发表在国际知名学术杂志Advanced Science (DOI:10.1002/advs.202104671)上,华东理工大学材料科学与工程学院博士研究生李享龙和同济大学附属上海市肺科医院博士研究生姜聪为论文的共同第一作者,华东理工大学材料科学与工程学院李永生教授、郝继娜副研究员和同济大学附属上海市肺科医院张鹏教授为共同通讯作者。上述研究工作得到了国家自然科学基金、上海市基础研究计划、上海市领军人才和上海市肺科医院创新群体项目等基金的支持。
论文信息:
A “Valve-Closing” Starvation Strategy for Amplification of Tumor-Specific Chemotherapy,Xianglong Li, Cong Jiang, Qinghua Wang, Shaobo Yang, Yuanyuan Cao, Ji-Na Hao*,Dechao Niu, Yan Chen, Bo Han, Xin Jia, Peng Zhang*,and Yongsheng Li*
Advanced Science
DOI:10.1002/advs.202104671
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202104671